
اختلالات اندوکرین
اختلالات اندوکرین
اگر چه در تعداد اندکی، اندازه تیرویید به طور قابل توجه ای افزایش می یابد ولی ما معمولا اهمیت ان را نادیده می گیریم.
با وجود این به نظر می رسد اندوکرینوپاتی ها با توجه به ماهیت بارداری و ترشح زیاد هورمون ، ارتباط بسیار نزدیکی با حاملگی دارند.
این مسئله با توجه به نقش هورمون لاکتوژن جفتی در دیابت (شایع ترین اندوکرینوپاتی بارداری) به بهترین نحو توضیح داده شده است.
بارداری همچنین از تاثیرات متقابل با بعضی اختلالات اندوکرین که بطور نسبی ناشی از اختلال اتوایمیون روندهای تنظیمی هستند برخوردار است.
تظاهرات بالینی این اختلالات، ناشی از ارتباط پیچیده میان عوامل ژنتیکی و محیطی و عوامل درون زا ست که سیستم ایمنی را در مقابل سلولهای هدف در اعضای اندوکرین فعال می کند.
مثلا کاشت سلولهای جنینی در اعضای مادر سبب تولید انتی بادی و تخریب بافت و اندوکرینوپاتیهای اتوایمیون می شود.
بیماریهای تیرویید
بیماریهای تیرویید در زنان جوان شایع است. بنابراین بطور شایع در بارداری با انها مواجه می شویم. ارتباط نزدیکی بین عملکرد تیرویید مادر و جنین وجود دارد و داروهای موثر بر تیرویید مادر ، غده تیرویید جنین را تحت تاثیر قرار می دهد.اتوانتی بادیهای تیرویید با افزایش سقط زودهنگام همراه هستند. همچنین هیپوتیروییدی درمان نشده و تیروتوکسیکوز کنترل نشده هر دو سبب پیامدهای نامطلوب بارداری می شوند.نکته اخر اینکه شواهد موجود نشان می دهند ممکن است شدت اختلالات اتوایمیون تیرویید در دوران حاملگی کاهش پیدا کند و صرفا بعد از زایمان بر شدت انها افزوده شود.
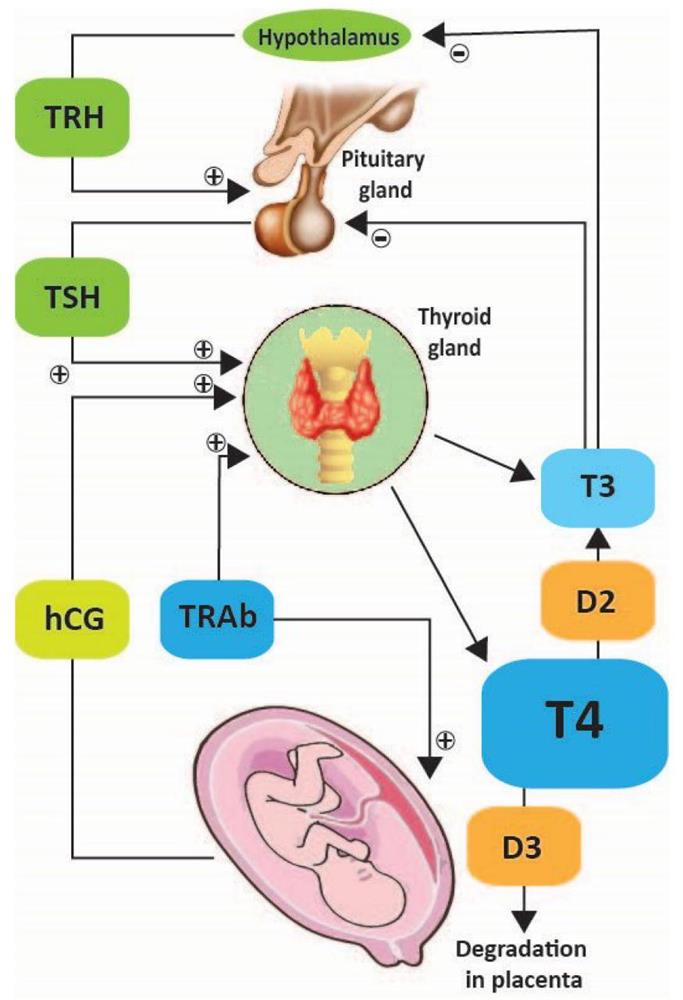
فیزیولوژی تیرویید و بارداری
تغییرات تیرویید مادر در دوران حاملگی بسیار چشمگیر است. تغییر طبیعی ساختار و عملکرد تیرویید گاهی اوقات با اختلالات تیرویید اشتباه می شود. اولا، غلظت TBG در سرم مادر همزمان با افزایش میزان تام یا متصل هورمونهای تیرویید افزایش می یابد. ثانیا، TSH در حال حاضر نقشی مهم در غربالگری و تشخیص بسیاری از اختلالات تیرویید دارد. گیرنده های TSH توسط مقادیر بسیار زیاد HCG مترشحه از تروفوبلاست های جفتی بطور ضعیف تحریک می شود.
چونTSH از جفت عبور نمی کند، تاثیر مستقیمی بر جنین ندارد.در ۱۲ هفته اول حاملگی که میزان hCG سرم به حداکثر می رسد ترشح هورمون تیرویید تحریک می شود. افزایش FreeT4 منجر به سرکوب TRH می شود. و در نتیجه ترشح TSH هم کاهش می یابد. به همین دلیل TRHدر سرم مادر غیرقابل اندازه گیری است. در مقابل TRHاز اواسط حاملگی به بعد در سرم جنین قابل تشخیص است، اما میزان ان ثابت است و در طول حاملگی با افزایش سن حاملکی افزایش نمی یابد.
در تمام طول حاملگی ، تیروکسین مادر به جنین منتقل می شود.تیروکسین مادر برای تکامل نرمال مغز جنین به ویژه قبل از شروع عملکرد غده تیرویید جنین ضروری است.
اگر چه تیرویید جنین بعد از ۱۲ هفته شروع به تغلیظ ید و ساخت هورمون تیرویید می کند ، همکاری و کمک تیروکسین مادری مهم است.
در حقیقت ۳۰ درصد تیروکسین سرم جنین در هنگام ترم منشا مادری دارد.
هنوز ، خطرهای تکاملی مربوط به هیپوتیروییدی مادر بعد از میانه بارداری بطور کامل شناخته نشده است.
دستورالعمل تیروئید در بارداری
خودایمنی و تیرویید مادر
اغلب اختلالات تیرویید ارتباط غیر قابل انکاری با اتوانتی بادی ها ی علیه حدود ۲۰۰ جزء تیروسیت دارند.
این انتی بادیها به طور متنوعی ممکن است عملکرد تیرویید را تحریک یا بلاک کنند، یا میتوانند باعت التهاب تیرویید شوند که گاهی منجر به تخریب سلولهای فولیکولی تیرویید می شود. اغلب این اثرات با هم همپوشانی دارند یا حتی بطور همزمان وجود دارند.
اتوانتی بادیهای محرک تیرویید که ایمونوگلوبولین های محرک تیرویید (TSI) نامیده می شودبه گیرنده TSH متصل شده و با تحریک ان سبب فعال شدن بیش از حد تیرویید و رشد ان می شوند.
اگر چه این اتوانتی بادیها در اغلب بیماران مبتلا به گریوز کلاسیک شناسایی می شود ، تولید همزمان انتی بادیهای بلوک کننده ممکن است این اثر را تضعیف کند.
تیرویید پراکسیداز یک انزیم غده تیرویید است که بطور طبیعی در جهت تولید هورمون تیرویید عمل میکند.
انتی بادیهای تیرویید پراکسیداز که قبلا اتوانتی بادیهای میکروزومال تیرویید نامیده میشدند ، علیه TPO ساخته می شوند و در ۱۵-۵ درصد همه خانمهای باردار وجود دارد.
در بعضی مطالعات این اتو انتی بادیها با سقط زودهنگام و زایمان پره ترم همراه بوده اند.
در مطالعه دیگر در بیش از ۱۰۰۰ خانم انتی TPOمثبت باردار ، ریسک زایمان پره ترم افزایش نیافت ولی ریسک دکولمان بیشتر بود.
همچنین این زنان در معرض خطر بالا برای اختلال عملکرد تیرویید بعد از زایمان هستند. و در معرض خطر "تمام عمر" نارسایی دایمی تیرویید می باشند.
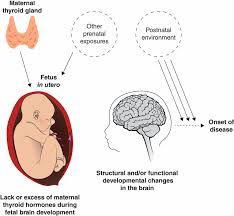
میکروکیمریسم جنینی
شیوع بیماری اتوایمیون تیرویید در زنان بیشتر از مردان است.یکی از توضیحات جالب برای این ناهمگونی، تردد سلولی مادری-جنینی است.
وقتی لنفوسیت های جنینی وارد گردش خون مادری می شوندممکن است بیش از ۲۰ سال انجا زنده بمانند.
تبادل سلولهای بنیادی میتواند باعث گیر افتادن این سلولها در بافتهای مادری ( مثلا غده تیرویید) شود که به این پدیده میکروکیمریسم جنینی می گویند.
شیوع بالای "سلولهای مثبت از نظر کروموزوم y " با استفاده از روش FISH در تیرویید زنان مبتلا به تیروییدیت هاشیموتو ( ۶۰ درصد ) و یا بیماری گریوز ( ۴۰ درصد) شناسایی شده است.
در مطالعه ای دیگر بر روی زنانی که جنین مذکر به دنیا اورده بودند، متوجه شدند که در بیماران مبتلا به تیروییدیت هاشیموتو تعداد سلولهای تک هسته ای مذکر در گردش خون مادر بیشتر بوده است. همچنین ممکن است میکروکیمریسم نقش محافظتی برا اختلالات اتوایمیون تیرویید داشته باشد.
هایپرتیروییدی
میزان بروز تیروتوکسیکوز یا هایپرتیروییدیسم در بارداری متغیر است و در صورتی که از معیار آستانه ای TSH متناسب با سن حاملگی استفاده شود، میزان بروز ان ۱۷-۲ مورد در ۱۰۰۰ تولد خواهد بود.
چون حاملگی طبیعی هم تظاهرات کلینیکی شبیه علایم ازدیاد تیروکسین را نشان می دهد ، ممکن استتشخیص تیروتوکسیکوز خفیف بالینی دشوار باشد.
علائم کمک کننده شامل تاکی کاردی که از افزایش ضربان قلب در حاملگی طبیعی شدیدتر است، تیرومگالی ، اگزوفتالموس و عدم وزن گیری علی رغم دریافت غذای کافی.
تست های ازمایشگاهی هم تایید کننده تشخیص است. کاهش چشمگیر TSH همراه با افزایش میزان سرمی T4 آزاد صورت می گیرد.
بطور نادر هایپرتیروییدی در اثر مقادیر بسیار بالای T3 سرم بوجود می اید که تیروتوکسیکوز T3 گفته میشود.
علت اصلی تیروتوکسیکوز در دوران بارداری ، بیماری گریوز است. گریوز یک پروسه اتوایمیون مختص ارگان است که با انتی بادیهای محرک گیرنده TSH ارتباط دارد.
چون این انتی بادیها برا هایپرتیروییدی گریوز جنبه تشخیصی دارند، سنجش انها برای تشخیص ، درمان و پیش آگهی در حاملگی های همراه با هایپرتیروییدی توصیه شده است.
در بیماران مبتلا به گریوز ، ممکن است علائم هایپرتیروییدی در ابتدا بخاطر رایز HCG و تحریک توسط ان بدتر شوند ولی بعدا به دنبال کاهش تیتر انتی بادی گیرنده در نیمه دوم حاملگی ، کاهش می یابد.
آمینو و همکاران دریافتند که سطح انتی بادی بلوک کننده در طول بارداری کاهش می یابد.
درمان تیروتوکسیکوز
تیروتوکسیکوز در بارداری را میتوان تقریبا در تمام موارد با داروهای تیونامیدی کنترل کرد.
پروپیل تیو اوراسیل (PTU) قبلا ترجیح داده می شد ، چون تا حدی سبب مهار تبدیل T4 به T3 میشد و در مقایسه با متی مازول به میزان کمتری از جفت رد می شود.
متی مازول هم با نوعی امبریوپاتی نادر همراه بود که با اترزی مری یا اترزی کوآن و یا اپلازی کوتیس( نوعی ناهنجای مادرزادی پوست ) مشخص میشود.
یوشیهارا و همکاران پیامدهای بارداری را در خانم های ژاپنی که در سه ماهه اول هایپرتیروییدی داشتند انالیز کردند و متوجه افزایش دو برابری ریسک مالفورماسیونهای جنینی ماژور در موارد تماس با متی مازول نسبت به یدید پتاسیم یا PTU شدند.
مخصوصا ۷ مورد از ۹ مورد اپلازی کوتیس و تنها مورد اترزی ازوفاژیال در گروه تماس با متی مازول بودند. البته مواردی از امبریوپاتی مرتبط با PTU هم گزارش شده است.
در سال ۲۰۰۹ ، FDA یک هشدار ایمنی در مورد هپاتوتوکسیسیته مرتبط با PTU منتشر کرد. این هشدار باعث شد انجمن تیرویید امریکا و انجمن اندوکرینولوژیستهای امریکا توصیه کنند درمان با متی مازول در سه ماهه اول شروع شود و سپس در سه ماهه دوم درمان به PTU تغییر کند.
عیب اشکار این رویکرد این است که ممکن است به کنترل ضعیف عملکرد تیرویید منجر شود. بر همین اساس در بیمارستان پارکلند ما به تجویز PTU در تمام طول حاملگی ادامه می دهیم.
لکوپنی گذرا در ۱۰ درصد خانمهای تحت درمان با داروهای انتی تیرویید رخ می دهد.ولی این عارضه نیاز به قطع درمان ندارد.
با وجود این ، در تقریبا 3/. درصد موارد آگرانولوسیتوز بطور ناگهانی رخ میدهد و قطع دارو را الزامی می سازد.این حالت وابسته به دوز نیست و بخاطر ماهیت شروع حاد و ناگهانی ان، شمارش سریال لکوسیتها در طول درمان مفید نیست. در نتیجه اگر تب یا گلو درد ایجاد شودبه بیمار توصیه می شود درمان را قطع کرده و CBC چک کند.
درمان ممکن است عوارص جانبی دیگری داشته باشد
اولا همان طور که قبلا گفته شد هپاتوتوکسیسیته یکی از عوارض است که در ۱/ درصد زنان درمان شده رخ می دهد.چک سریال انزیمهای کبدی نمیتواند از هپاتوتوکسیسیته فولمینانت مرتبط با PTU پیشگیری کرد.ثانیا تقریبا در ۲۰ درصد بیماران درمان شده با PTU انتی بادی ANCA ایجاد می شود.علیرغم این موضوع، تنها درصد کمی از این افراد به واسکولیت دچار می شوند.
در نهایت ، اگر چه تیونامیدها پتانسیل ایجاد عوارض جنینی دارند ، این عوارض ناشایعند. در بعضی موارد تجویز تیونامیدها ممکن است حتی برای جنین جنبه درمانی داشته باشد، چون انتی بادیهای گیرنده TSH ازجفت عبور می کند و میتوانند باعث تحریک غده تیرویید جنین شوند و ایجاد تیروتوکسیکوز و گواتر کنند.
تعیین دوز شروع تیونامید تجربی است.
انجمن تیرویید امریکا توصیه کرده است در بیماران غیرحامله متی مازول با دوز بالاتر ۱۰ تا ۲۰ میلی گرم روزانه خوراکی شروع و با دوز نگهدارنده کمتر یعنی ۵ تا ۱۰ میلی گرم ادامه یابد.
اگر PTU انتخاب شده، بسته به شدت بیماری با دوز ۵۰ تا ۱۵۰ میلی گرم خوراکی سه بار در روز شروع می شود.
گاهی اوقات دوز های ۶۰۰ میلی گرم یا بیشتر لازم است.
همان گونه که قبلا توضیح داده شد ما معمولا درمان را در سه ماهه دوم به متی مازول تغییر نمی دهیم.
هدف ، درمان با پایین ترین دوز ممکن تیونامید برای حفظ میزان هورمونهای تیروییدی در حد کمی بالاتر یا در سطح فوقانی حد طبیعی همزمان با حفظ میزان سرکوب شده TSH می باشد.
غلظت T4 ازاد سرم هر ۴ تا ۶ هفته سنجیده می شود.
بعد از کنترل تیروتوکسیکوز بطور طبی ، میتوان ساب توتال تیروییدکتومی انجام داد.
این عمل بندرت در دوران بارداری انجام میشود ، ولی ممکن است برای افراد معدودی که از درمان طبی پیروی نمی کنند یا درمان دارویی در انها خاصیت توکسیک دارد مناسب باشد.
بهترین زمان برای این جراحی، نیمه دوم حاملگی است. معایب تیروییدکتومی شامل رزکسیون ناخواسته غدد پاراتیرویید و آسیب عصب راجعه حنجره ای هستند.
تخریب تیرویید با ید رادیواکتیو درمانی در طول بارداری ممنوع است.دوزهای لازم برای این کار ممکن است باعث تخریب غده تیرویید جنین شود. به همین دلیل وقتی بطور غیرعمدی ید رادیواکتیو داده می شود بسیاری از پزشکان سقط را پیشنهاد می کنند.
هر گونه تماس جنین با این مواد باید به دقت ارزیابی شود. میزان بروز هیپوتیروییدی جنینی بستگی به سن بارداری و دوز ید رادیواکتیو دارد.
شواهدی وجود ندارد که نشان بدهد تجویز ید رادیواکتیو قبل از بارداری، در صورت داشتن فرصت کافی برای از بین رفتن اثار رادیواکتیو و یوتیرویید شدن ، باعث انومالی های جنینی شود .
کمیسیون بین الملل حفاظت رادیولوژیک توصیه کرده است که زنان تا ۶ ماه بعد از درمان تخریبی با ید رادیواکتیو از حاملگی جلوکیری کنند.
همچنین در دوران شیردهی پستان مقدار چشمگیری ید تغلیظ می کند. در نتیجه ممکن است نوزاد در اثر خوردن شیر حاوی ید ۱۳۱ در معرض خطر قرار گیرد و مادر هم در اثر تابش مقادیر زیاد به پستان در معرض خطر قرار گیرد.
برای محدود کردن تماس مادر با اشعه ، در صورت رعایت وقفه سه ماهه بین شیردهی و درمان تخریبی می توان بطور قابل اعتمادی از پسرفت پستان مطمئن شد.
بیماری پاراتیرویید
عملكرد هورمون پاراتیروئیدPTH،تثبیت غلظت كلسیم مایع خارج سلولی است.این هورمون ٨٥اسید امینه ای،به طور مستقیم بر روی استخوان و كلیه وبه طور غیر مستقیم ،از طریق اثر بر ساخت ویتامین Dبر روده باریك تاثیر می گذارد تا میزان كلسیم سرم را افزایش دهد.
غلظت سرمی كلسیم یونیزه،ازطریق نوعی سیستم فد بك منفی،ترشح هورمون پاراتیرویید را تنظیم می كند.
كلسیتونین نوعی هورمون پاراتیروییدی پر قدرت است كه از راههای زیادی به عنوان انتاكونیست فیزیو لوژیك هورمون پاراتیرویید عمل می كند
نیازقابل توجه جنین به كلسیم (٣٠٠میلی گرم در روز در اواخرحاملگی و در مجموع٣٠گرم ونیز افزایش دفع كلسیم در اثر افزایش فیلتراسیون گلومرولی،سبب افزایش چشمگیرنیاز مادر به كلسیم می شود.
در دوران حاملگی میزان سرمی١و٢٥دی هیدروكسی ویتامین Dبه دو برابر می رسدو این مساله جذب كلسیم را از دستكاه گوارش افزایش می دهد.
این هورمون احتمالا از جفت و دسیدوا منشا میگیرد،چون در دوران حاملگی میزان PTHكمتر از طبیعی است و یا كاهش پیدا میكند.
میزان تام كلسیم سرم با كاهش غلطت البومین سرم كاهش پیدا می كند،اما میزان كلسیم یونیزه بدون تغییر باقی می ماندتعدادی از محققان نقشی را برای فاكتور رشد شبه انسولین ١در هموستاز كلسیم و باز چرخش استخوان مادر پیشنهاد كرده اند.
هـیپر پاراتیروئیدی
هیپر كلسمی در 90درصد از هیپر پاراتیروییدی یا سرطان ناشی میشود.چون بسیاری ار سیستم های خودكار ازمایشگاهی قابلیت اندازه گیری كلسیم سرم را نیز دارنداكثر موارد بیماری در یك ازمایش روتین تشخیص داده می شود تا از روی سمپتوم های بیمار .
میزان شیوع این اختلال ٣-٢مورد در هر ١٠٠٠زن گزارش شده اما برخی تخمین می زنندكه در صورت در نظر گرفتن موارد بدون علامت ،این میزان به ١٤در١٠٠٠برسد.علت تقریبا٨٠درصدموارد بیماری ،ادنوم منفرد و علت ١٥درصد دیگر،عملكردبیش از حد هر چهار غده است.
در بقیه موارد یك بدخیمی علت افزایش كلسیم اشكار می باشد.هورمون پاراتیرویید تولید شده توسط تومورها،همانندهورمون طبیعی نیستو ممكن است با سنجشهای روتین تشخیص داده نشود.در اكثر بیماران ،كلسیم سرم فقط بیش از ١تا١/٥میلی گرمدر دسی لیتر نسبت به حداكثرمحدوده طبیعی افزایش می یابد.بدین ترتیب می توان توضیح داد كه چرا فقط ٢٠درصد از افرادی كه در انان میزان سرمی كلسیم به طور غیر طبیعی افزایش یافته است،علامتدار هستند.
گرچه در یك چهارم موارددر صورت ادامه افزایش میزان كلسیم سرم ،علایم ظاهر میشوند.كریزهیپركلسمیك به صورت استوپروز ،تهوع،استفراغ،ضعف و خستگی و دهیدراتاسیون تظاهر پیدا میكند.تمام زنان با هیپر پارای سمپتوماتیك باید درمان شوند.اندیكاسیون پاراتیروئیدكتومی به شرح زیر هستند:میزان كلسیم سرم ١/٠میلیگرم در دسی لیتر بیشتر از حد فوقانی طبیعی،میزان كلیرانس كراتینین كمتر از ٦٠میلی لیتر در دقیقه،كاهش تراكم استخوان و یا سن كمتر از ٥٠.
درافرادی كه فاقد این معیارها هستند باید سالانه میزان كلسیم سرم و كلیرنس كراتینین هر یك تا دوسال اندازه گیری شود
هیپر پاراتیروئیدیسم در حاملگی
در بررسی مروریSchnatzوThaxtonبا كمتر از٢٠٠مورد گزارش شده هیپر پاراتیروئیدی در حاملگی برخورد كردند.همانند بیماران غیر حامله ،در زنان حامله نیز معمولا هیپر پارا ناشی از ادنوم پاراتیرویید است .مواردی از بیماری توصیف شده اند كه ناشی از تولید نابه جای هورمونپاراتیروییدو یا بندرت ناشی از كارسینوم پاراتیرویید بوده اند،علایم عبارتند از:استفراغ،ضعف عمومی ،سنگهای كلیویو اختلالات روانی.گاهی اوقاتپانكراتیت یافته اولیه بیماری است.
از دیدگاه تئوریك،حاملگی به دلیل انتقال قابل توجه كلسیم به جنین و نیز تشدید دفع كلیوی كلسیم ،باعث بهبود هیپر پاراتیروئیدیسم می شود.
با وجود این،هنگامی كه "اثار حفاظتش"حاملگی قطع می شوند،خطر قابل توجه كریز هیپركلسمیك بعد از زایمان وجود دارد.این عارضه مخاطره انگیز زندگی در سطح سرمی كلسیم بالاتر از ١٤میلیگرم در میلی لیتر دیده میشودكه با علایم تهوع و استفراغ و لرزش و دهیدراتاسیون و تغییرات وضعیت منتال مشاهده می شود.گزارشهای اولیه ،حاكی از افزایش بروز مرده زایی و زایمانهای پره ترم در حاملگیهای همراه با هیپرپاراتیروییدی بودند ،در بررسی جدیدتر كاهش میزانstill birth ومرگ نوزادو تتانی نوزاد گزارش شده است .انسیدانس بروز پره اكلامپسی ٢٥درصد گزارش شده بود .
تدابیر درمانی در حاملگی
در دوران حاملگی در صورت علامت دار بودن زن حامله،خارج كردن ادنوم پاراتیرویید از طریق جراحی ارجح است كه مانع موربیدیتی جنین و نوزاد می شودو كریزهایپاراتیرویید پست پارتوم را كاهش می دهد.زنان حامله حتی در تریمستر سوم تجسس انتخابی گردن را بخوبی تحمل می كنند.حداقل در دو مورد ادنوم مدیاستینال در وسط دوران بارداری برداشته شد.
درمان دارویی ممكنه در خانم های باردار اسمپتوماتیك با هیپر كلسیمی خفیف مناسب باشد.در این موارد بیماران باید دقیقا در مرحله پر یپریوم از نظر كریز هیپر كلسیمی مانیتور شوند.درمان دارویی اولیه می تواند كلسیتونین برای كاهش ازاد سازی كلسیم اسكلتال و یا فسفات خوراكی ١تا١/٥گرم روزانه در دوزهای منقسم برای باند شدن با كلسیم زیادی باشد.برای زنان با سطوح بالای خطرناك سرمی كلسیم ویا انها كه از نظر ذهنی دچار اشكال كریز هیپر كلسمیك شده انددرمان فوری انجام میشود.ایجاد دیورز با تجویز داخل وریدی سالین نرمال اغاز می شود و تارخدی ادامه می یابد كه جریان ادرار به بیش از ١٥٠میلی لیتر در ساعت برسد .فوروسماید با دوز مرسوم تجریز می شود تا باذجذب توبولی كلسیم را مهار كند .توجه دقیق به پیشگیری از هیپوكالمی و هیپو منیزمی حایز اهمیت است ،درمان كمكی شامل میترامایسین است كه مانع باذجذب استخوانی می شود.
اثر بر نوزاد
در نوزاد طبیعی ،میزان كلسیم خون بند ناف از میزان ان در خون مادر بیشتر است.در صورت ابتلای مادر به هیپر پارا تیروییدی،افزایش میزان كلسیم در جنین،سبب سركوب شدیدتر عملكرد پاراتیرویید جنین می شود.بنابر این میزان كلسیم سرم نوزاد بعد تولد بسرعت كاهش می یابد و ١٥-٢٥درصد این نوزادان دچار درجات شدید هیپوكلسیمی با یا بدون تتانی می شوند.هیپر پاراتیروییدیسم در نوزاد بعلت هیپر پارای مادرمعمولا گذراست و با كلسیم و كلسیتریول درمان میشود .البته دومی در درمان نوزاد نارس موثر نیست زیرا رسپتور روده ای ویتامین Dكافی نمی باشد ،تتانی یا تشنج نئوناتال نشانه افزایش هیپرپراتیروییدیسم مادر است.
هیپوپاراتیروئیدیسم
شایعترین علت هیپوكلسمی ،هیپوپاراتیروییدیسم است كه معمولا به دنبال جراحی تیرویید یا پاراتیرویید ایجاد می شود.كه در ٧درصد توتال تیروئیدكتومی ها دیده می شود.كه خود را با اسپاسم عضله فاسیال و كرامپ عصلانی وپارستزی لب ها و زبان و انگشتان دست و پا نشان می دهد.كه ممكنه به سمت تتانی و تشنج پیشرفت كند.زنان حامله مبتلا به هیپوكلسمی مزمن ،ممكن است دارای جنینی با دمینرالیزاسیون اسكلتی باشندكه در دوره نوزادی سبب شكستگیهای استخوانی متعدد میشود.درمان زنان بیمار شامل:calcitriol،dihydrotachystrolیا دوز بالای ویتامین D3از 50000تا 150000واحد در روز می باشد،گلوكنات كلسیم یا لاكتات كلسیم در دوزهای ٣تا٥گرم در روز و رژیم كم فسفات می باشد.
دوزهای بالای ویتامین D جنین را به مخاطره نمی اندازند.حین درمان سطح كلسیم خون زنان با هیپوپارا شناخته شده باید اندازه گیری شود .بعلت جذب بالای كلسیم حین بارداری ،دوز پایینتری از كلسیم نیاز است ویا نیاز جنینی برای كلسیم دوز بالاتری را بطلبد .هدف درمان حین حاملگی نكهداری سطح كلسیم در حداقل رنج نرمال می باشد.
استئوپروز مرتبط با حاملگی
حتی در صورت افزایش چشمگیر میزان نیاز به كلسیم،مشخص نیست كه ایا حاملگی در اكثرزنان سبب استئوپنی میشود یا نه!در یك مطالعه ٢٠٠خانم باردار كه ماس استخوانی اندازه گیری شده بود،یك كاهش در دانسیته استخوانی طی حاملگی مشاهده شد.زنان شیرده ،حاملگی دو قلویا با low body mass index
ریسك بالاتری برای bone loss دارند.
توماس و همكاران كاهش ٣تا ٤درصدی دانسیته مینرال استخوانی طی بارداری را نشان دادند
شیردهی باعث بالانس منفی كلسیم شده كه از طریق جذب اسكلتی مادر تصحیح میشود.در سونوحرافی نیز كاهش ماس استخوان كورتیكال در زنان شكم اول جوان در مقایسه با نولی پار ها مشاهده شده .به طور نادر بعضی زنان دجار استئوپروز ایدیوپاتیك حین حاملگی یا شیردهی می شوند.
شایعترین سمپتوم استئوپروزكمردرد در اواخر حاملگی ویا بعد زایمان می باشد.سایر علائم شامل درد هیپ یكطرفه یا دوطرفهو دشواریدر تحمل وزن هستند تا زمانی كه كاملا بی حركت شوند،در بیش از نیمی اززنان دلیل واضحی برای استئو پنی یافت نمیشود.بعضی علل شامل هپارین،استراحت طولانی در بستر و كورتیكو استرویید تراپی می باشد.در بعضی مواردهیپر پاراتیروئیدیسم واضح یا تیرو توكسیكوز در نهایت ایجاد میشود.درمان مشكل ساز است و شامل كلسیم و ویتامین دی وكنترل استاندارد درد می باشد. در عكس ٥٨رادیوگرافیهیپ خانمی كه در بیمارستان پاركلندطی سه ماهه اخر بارداری بعلت استئوپروز گذرای بارداری بستری شده بود دیده می شود.در زنانی كه دچار استئوپنی همراه بارداری میشوند كنترل طولانی مدت نشان میدهد گرچه دانسیته استخوانی بهبود می یابد ولی این زنان و فرزندانشان ممكن است دچار استئوپنی مزمن شوند .درمان پره ناتال زنان نرمال با كوله كلسیفرول١٠٠٠واحد در روز باعث افزایش محتوی مینرال استخوانی بچه ها نشده گرچه كه باعث جبران ویتامین دی مادر میشود
اختلالات غده فوق كلیه
حاملگی اثار شدیدی بر ترشح بخش قشری غده فوق كلیه و كنترل یا تحریك ان دارد.
فئوكروموسیتوم
تومرهای كرومافین هستند كه كاتكول امین ترشح میكنند و معمولا در مدولای فوق كلیه قرار دارند ،اما ١٠درصد انها در گانگلیونهای سمپاتیك واقع هستند .این تومورها ،تومر ١٠درصد نامیده میشوند،چون حدود ده درصد انها دو طرفه و ده درصد انها خارج فوق كلیه و ده درصد انها بدخیم هستند. در بعضی از سندرمهای نئوپلازی متعدد اندوكرین از نوع اتوزوم غالب یا مغلوب و نیز در نورو فیبروماتوز و بیماری فون هیپل لیندو دیده می شود.
این تومر حدودا یك پنجاه هزارم حاملگی ها را عارضه دار می كندو در یك دهم درصد بیماران هیپرتنسیو مشاهده میشود.گرچه كه به طور شایع به علت دیگری حین اتوپسی كشف می شوند.
علائم معمولا حمله ای هستند و به صورت كریز هیپر تانسیون ،اختلالات تشنجی و یا حملات اضطراب تظاهر پیدا می كنند.در ٦٠درصدبیماران هیپرتانسیون پا برجاباقی می ماند،امادر نیمی از این بیماران ،كریزهای حمله ای نیز دیده می شوند.سایر علائم در طول حملات عبارتند از :سردرد ،تعریق شدید،تپش قلب،درد قفسه سینه،تهوع،و استفراغ و رنگ پریدگی یا بر افروختگی (گر گرفتگی)
تست استانداردغربالگری،سنجش میزان متابولیتهای كاتكول امینها در نمونه ادرار ٢٤ساعته است.برای اثبات تشخیص،در نمونه ادرار ٢٤ساعته حداقل دو سنجش از سه سنجش زیر صورت میگیرد:
میزان كاتكول امینهای ازاد،میزان متانفرینها،و یا میزان وانیلیل مندلیك اسیدVMA.
تعیین مقادیر كاتكول امینهای پلاسما. روشی دقیق محسوب میشود.
در بیماران غیر حامله،تعیین محل تومور در غده فوق كلیه با CTیا mri معمولا موفقیت امیز است.در اكثر موارد ،ادرنالكتومی لاپاراسكوپیك درمان ارجح محسوب می شود.
فئوكروموسیتوم در دوران حاملگی
فئوكروموسیتومها از عوارض نادر اما خطرناك حاملگی هستند.در بررسی اولیه ٨٩بیمار ذكر شده بودند كه ٤٣نفر از انان فوت كرده بودند.در این بررسی در صورت عدم تشخیص تومر قبل از زایمان ،میزان مرگ مادران بسیار بیشتر بود.٥٨در برابر ١٨درصد.
با درمان مدرن و امروزی میزان مرگ و میر مادری كاهش یافته است ولی هنوز قابل توجه است.در بررسی ٧٥مورد تشخیص قبل از زایمان مهمترین عامل كاهش مرگ و میر مادری است.گروه دیگری outcome خوبی در صورت تشخیص بعد از زایمان را كزارش نموده اند.
تشخیص بیماری،مشابه تشخیص در بیماران غیر حامله است .در دوران حاملگی ،MRI تكنیك رادیولوژیك انتخابی محسوب میشود ،چون تقریبادر تمام موارد می تواندمحل فئوكروموسیتومهای فوق كلیوی و خارج كلیوی را تعیین كند.در بسیاری از موارد،مشكل اصلی،افتراق پره اكلامپسی از بحران هیپرتانسیوایجاد شده در اثرفیوكروموسیتوم است.دو مورد فئوكروموسیتوم را در ٥٦حاملگی در ٣٠زن مبتلا به بیماری فون هیپل لیندو تشخیص دادند.
تدابیر درمانی
كنترل فوری هیپرتانسیون و علایم ان با داروهای مسدود كننده الفا ادرنرژیك مانند فنوكسی بنزامین ضروری است .دوز این دارو ١٠تا٣٠میلی گرم دو تا چهار بار در روز است.بعد از مسدود كردن الفا،می توان در صورت نیاز،به منظور درمان تاكی كاردی اقدامبه تجویز داروی بتا بلاكر كرد.در بسیاری از موارد تجسس با عمل جراحی و برداشتن تومور ،دردوران حاملگی صورت می گیرد.خارج سازی موفقیت امیز تومرهای كلیه بالاپاراسكوپی گزارش شده است ،اگر تومور در مراحل بعدی شناسایی شود همزمان سزارین برنامه ریزی شده توام با اكسزیون تومور و هم رزكسیون تومور در دوره بعد از زایمان ،روشهای مناسبی محسوب میشوند.تومرهای عودكننده مشكل افرین هستند و حتی در صورت كنترل مناسب فشار خون ،ممكن است هیپرتانسیون خطرناك در حول و حوش زایمان رخ بدهد.ما از سه زن كه عود فئوكروموسیتوم انان در دوران حاملگی مشخص شده بود مراقبت كرده ایم ،درمان هیپرتانسیون در هر سه نفر بافنوكسی بنزامین صورت گرفته بود دو نوزاد سالم بودند اما نوزاد سوم در مادری كه مبتلا به یك تومور بزرگ بود و روزانه ١٠٠میلی گرم فنوكسی بنزامین دریافت می كرد ،مرده به دنیا امده بود .در هر سه زن ،تومور بعد از زایمان رزكسیون شد.
سندرم كوشینگ نادر است
نسبت زن /مرد ١/٣ است (زنان بیشتر )
اكثریت موارد یاتروژنیك هستند (ناشی از درمان طولانی مدت كورتیكوستروییدها )
بیماری كوشینگ اشاره میكند به هیپرپلازی أدرنال دوطرفه كه توسط ادنوم هیپوفیز (ترشح كننده كورتیكوتروپین ) ایجاد میشود
كورتیكوتروپین ACTHنیز نامیده میشود (آدرنوكورتیكوتروپیك )
اكثریت آدنومها میكروادنوم هستند با سایز كمتر از ١ سانتی متر و نیمی از انها كمتر از 5میلیمتر هستند
ندرتا ترشح غیرنرمال CRH هیپوتالامیك ممكن است سبب هیپرپلازی كورتیكوتروپیك شود .
اینچنین هیپرپلازی ممكن است توسط تومورهای غیرآندوكرینی كه پلی پپتیدهایی (مشابه كورتیكوتروپین یا CRF )تولید میكنند هم ایجاد شود
كمتر از یك چهارم موارد سندرم كوشینگ غیر وابسته به كورتیكوتروپین هستند و اكثریت انها توسط یك آدنوم آدرنال ایجاد میشوند ( تومورهایی معمولا دوطرفه و نیمی از انها بدخیم ) كه گاهی با افزایش اندروژن همراه هستند و ممكن است بسمت ویریلیزاسیون شدید هدایت كنند
ساختار بدنی كوشینگویید بطور تیپیك توسط رسوب بافت چربی ایجاد میشود كه بطور مشخص سبب ایجاد moon face -bufallo hump-چاقی تنه ای -احساس خستگی و ضعف-هایپرتنشن-هیرسوتیسم-آمنوره میشود كه هر كدام از اینها در 75-85درصد بیماران غیرحامله مشاهده میشود .
تغییرات شخصیت -استعداد كبودی -استریاهای پوستی شایع هستند .
تا 60%ممكن است تحمل گلوكز مختل داشته باشند .
تشخیص میتواند مشكل باشد و توسط تستهای زیر حدس زده شود
١-سطح كورتیزول پلاسمای بالا رفته كه توسط دگزامتازون نمیتواند ساپرس شود
٢- افزایش ترشح ادراری كورتیزول آزاد در ادرار ٢٤ ساعته
هیچكدام از تستها بطور كامل دقیق نیستند و هر كدام در بیماران چاق بسختی تفسیر و تعبیر میشوند
ازسطح كورتیكوتروپین سرم -CT-MRI برای تشخیص هیپرپلازی یا لوكالیزه كردن تومور (ادرنال یا هیپوفیز) استفاده میشود
سندرم كوشینگ و حاملگی
چون بیشتر زنان سندرم كوشینگ وابسته به كورتیكوتروپین دارند ، افزایش آندروژن همراه ممكن است باعث unovulationشودو حاملگی نادر است .
در تحقیقی 140مورد گزارش كردند از سندرم كوشینگ در حاملگی .در حالیكه در غیر حامله ها نیمی از این بیماران توسط آدنوم ادرنال غیر وابسته به كورتیكوتروپین ایجاد میشود .
ندرتا %30موارد از ادنوم هیپوفیز و %10از كارسینوم آدرنال بوجود میایند .
در همه گزارشها مشكلات در تشخیص بعلت افزایش فیزیولوژیك (كورتیزول پلاسما -كورتیكوتروپین -سطح CRF در حاملگی )بوجود میاید .
اندازه گیری دفع كورتیزول ادرار ٢٤ساعته (با در نظر گرفتن سطح نرمال كه در حاملگی ایجاد میشود ) توصیه میشود .
عاقبت حاملگی در زنان با سندرم كوشینگ
نارسایی قلبی طی حاملگی شایع است و یك علت عمده مورتالیتی مادر است .
هیپركورتیزولیسم در حاملگی ممكن است همچنین سببترمیم ضعیف زخم -شكستگی استیو پروتیك -عوارض روانی شود .
درمان مدیكال طولانی مدت برای سندرم كوشینگ معمولا ناموثراست و درمان قطعی رزكشن ادنوم ادرنال یا هیپوفیز یا ادرنالكتومی دو طرفه برای هیپرپلازی است .
در طول حاملگی ممكن است درمان هایپرتنشن (در بیماران خفیف )تا زمان زایمان كافی باشد . در یك مقاله تحقیقی در 20زن با سندرم كوشینگ بیشتر انهادرمان مدیكال اولیه با متیراپون (بعنوان یك درمان موقتی )تا درمان قطعی با جراحی پس از زایمان داشتند . و چند نفر با كتوكونازول خوراكی درمان شده بودند . با اینحال چون این دارو همچنین استروییدوژنز بیضه را بلوك میكند لذا درمان با ان در طی حاملگی با جنین پسر مشكل زا میشود .
میفه پریستون (مشتق نور اتیندرون) كه برای اینداكشن و سقط استفاده میشود برای درمان بیماری كوشینگ در آینده پیش بینی شده اما بدلایل آشكار نباید در حاملگی استفاده شود
اگر لازم باشد میتوان آدنوم هـیپوفیز را بوسیله رزكشن ترانس اسفنوییدال درمان كرد .آدرنالكنومی یكطرفه در ابتدای تریمستر سوم بطور safeانجام شده است و میتواند درمان curative باشد .
بیماری آدیسون adrenal insufficiency
عدم كفایت ادرنوكورتیكوییدال اولیه نادر است چون بیشتر از %90كل حجم غده باید تخریب شود تا سمپتومها بارز شوند و توسعه یابند .
آدرنالیت اتو ایمیون شایعترین علت در كشورهای پیشرفته است اما TB شایعترین اتیولوژی در كشورهای فقیر است .
انسیدانس به میزان 1/3000تولد در نروژ و در امریكا 1/10000تا 1/20000 ذكر شده است
یك افزایش انسیدانس بیماریهایی همراه با ادیسون دیده شده است مثل تیروییدیت هاشیموتو -عدم كفایت تخمدان اولیه -تیپ یك دیابت - بیماری گریوز
این سندرم اتو ایمیون چند غده ای همچنین شامل : پرنیشس انمیا -ویتیلیگو - الوپسی - نان تروپیكال اسپرو - میاستنی گراو میباشد .
هایپوفانكشن آدرنال درمان نشده غالبا"سبب نازایی میشود اما با درمان جایگزینی اوولاسیون بحال اول بر میگردد.
اگر درمان نشود سمپتومها غالبا"شامل : ضعف -خستگی-تهوع و اسفراغ - كاهش وزن میشوند
چون سطح كورتیزول سرم طی حاملگی زیاد میشود با یافتن یك سطح پایین باید سریعا یك تست كوزین تروپین انجام شود تا فقدان پاسخ به كورتیكوتروپین انفوزیون شده را اثبات كنیم
در یك مطالعه بزرگ كوهورت ١١٨٨ زن با بیماری آدیسون با بیشتر از ١١٠٠٠ زن همسن به عنوان گروه كنترل كه بین سالهای ١٩٧٣-٢٠٠٦ زایمان كرده بودند مقایسه شدند
زنانی كه بعنوان عدم كفایت آدرنال طی سه سال فاصله از زایمان تشخیص داده شده بودند بطور واضحترى بیشتر از زنان گروه كنترل دچار زایمان زودرس-زایمان یك نوزاد با وزن كم - واینكه C/S شوند میشدند
عده ای دیگر از محققین عواقب جانبی مشابهی را گزارش كردند
بیشتر زنان حامله با بیمارى آدیسون قبلا"گلوكوكورتیكویید و داروهای جایگزین مینرالوكورتیكوییدها میگرفتند . اینها باید ادامه داده میشد و بیمار براى شواهد (یا عدم كفایت یا جایگزینی بیش از حد )observe میشدند
در طی لیبر -دلیوری - پست پارتوم یاپس از یك پروسیجر جراحی جایگزینی كورتیكوسترویید ها بطور محسوسی باید افزایش داده شود (بنام stress dose) كه پاسخ نرمال آدرنال را تخریب كنند . كه معمولا" هیدروكورتیزون 100mgبطور وریدی هر ٨ ساعت برای ٤٨ ساعت داده میشود
و مهم است كه سایر علل شوك غیراز آدرنوكورتیكال اینسافیشنسی فورا" تشخیص داده و درمان شوند ( مثل سپتیك شوك - شوك هموراژیك )
primary aldosteronism
١-هیپر آلدوسترونیسم در تقریبا" %75بیماران توسط آدنوم ادرنال -سندرم conn ایجاد میشود
٢-ایدیو پاتیك بای لترال آدرنال هیپرپلازی عامل بقیه موارد الدوسترونیسم اولیه است
٣-و تعدادی هم در اثر كارسینوم ادرنال ایجاد میشوند
یافته ها شامل هایپرتنشن -هیپوكالمی -ضعف عضلانی هستند
اثبات تشخیص با سطوح بالای سرمی یا ادراری آلدوسترون است
در حاملگی نرمال (همانطور كه در فصل چهار بحث شده ) پروژسترون عمل آلدوسترون را بلوك میكند ولذا سطوح خیلی بالایی از آلدوسترون داریم .لذا تشخیص هیپر الدوسترونیسم طی حاملگی میتواند سخت باشد .
چون در زن حامله با هیپرآلدوسترونیسم سطوح رنین ساپرس میشود ممكن است نسبت فعالیت آلدوسترون /رنین برای تشخیص مفید باشد
با پیشرفت حاملگی هایپرتنشن بدتر میشود و درمان طبی شامل مكملهای پتاسیم و درمان ضد فشارخون است
در بسیاری موارد هایپرتنشن به اسپیرینولاكتون پاسخ میدهد اما بتا بلوكرها یا كلسیم چانل بلوكرها ممكن است ارجح باشند ( بخاطر پتانسیل اثرات انتی اندرژنی اسپیرینولاكتون روی جنین )
محققین موردی از استفاده موفق از آمیلوراید در یك زن حامله گزارش كردند . و نیز استفاده از eplerenone هم گزارش شده كه یك آنتاگونیست انتخابی رسپتور آلدوسترون است .
رزكسیون لاپاروسكوپیك تومور روش درمانی است (curative)
بیماریهای هیپوفیز
هیپوفیز بطور موثری در حاملگی بزرگ میشود
عمدتا" از هیپرپلازی سلولهای لاكتوتروف( كه توسط تحریك استروژنی القا میشود ) ایجاد میشود
چندین بیماری هـیپوفیزی میتوانند همچنین حاملگی را عارضه دار كنند
پرولاكتینوما
این ادنومها( بخاطر ظهور روشهای بررسی پرولاكتین سرم) اغلب در زنان غیر حامله كشف میشوند .سطح سرمی كمتر از 25pg/cc در زن غیر حامله نرمال نظر گرفته میشود .سمپتومهای آدنوما و یافته ها شامل آمنوره - گا لاكتوره -هیپرپرولاكتینمی است .
تومورها از روی سایزشان كه با CTیا MRI اندازه گیری میشوند دسته بندی میشوند .
میكروادنوم كمتر یا مساوی 10 میلیمتر است
ماكروادنوم بیشتر از 10میلیمتر است
درمان برای میكرو ادنومها معمولا با برموكریپتین است ( یك آگونیست دوپامین و مهار كننده پرولاكتین قوی ) كه معمولا" اوولاسیون را بحال اول بر میگرداند .
برای ماكروادنوم سوپراسلار اكثرا رزكشن جراحی قبل از تلاش برای حامله شدن را توصیه میكنند
در یك آنالیز مشترك از بیشتر از 750 زن حامله با پرولاكتینوما تنها 2/4 % با میكروادنوم دچار بزرگی سمپتوماتیك طی حاملگی شدند با اینحال بزرگی سمپتوماتیك ماكروادنوم طی حاملگی شایعتر است .
(در 21% از 228 زن حامله )
در تحقیق سال 2007 گزارش كردند كه 15-35 درصد ماكروادنومهای سوپراسلار بزرگی تومور داشتند كه عامل اختلالات بینایی -سردرد -دیابت بیمزه میشود
ادنومهای نان فانكشن میتوانند سبب سمپتومهای بسط و توسعه هیپوفیز هم در حاملگی بشوند .
زنان حامله با میكروادنوم باید بطور مرتب برای سردرد -سمپتومهای بینایی سوال شوند . زنان با میكروادنوم خیلی تنگتر و نزدیكتر پی گیری میشوند و تستهای میدان بینایی در طول هر تریمستر انجام میدهند . CTیا MRI فقط اگر سمپتومها گسترش یافتند انجام میشود .
تصویر MRI
ادنوم هیپوفیز كه یك توده سلار و سوپرا سلار هایپرintense رانشان میدهد . به مطبق بودن مایع كمپلكس بداخل توده دقت كنید كه در حین جراحی یك محل خونریزی بود .
سطوح سریال پرولاكتین سرم بدلیل افزایش نرمال ان طی حاملگی استفاده كمی دارد .
بزرگ شدن سمپتوماتیك تومور باید فورا" با یك انتاگونیست دوپامین درمان شود .
سلامت برموكریپتین طی حاملگی بخوبی ثابت شده . پروفایل safety
برای كابرگولین كمتر شناخته شده است كه تا حد فزاینده ای در زن غیر حامله بخاطر تحمل بهتر و اثر بیشتر استفاده میشود . كابرگولین عموما"برای استفاده در حاملگی safe در نظر گرفته میشود .
در سال 2010 تعداد 100 زن كه در حاملگی در معرض كابرگولین بودند را شرح دادند كه هیچ عارضه جانبی نداشتند. و نیز یافته های مشابهی در 85 زن حامله ژاپنی در معرض قرار گرفته دیده شد .
برای زنانی كه هیچ پاسخی به دارو نداده باشند جراحی توصیه میشود
Acromegaly
توسط افزایش ترشح أنرمال هورمون رشد (معمولا" از یك آدنوم هیپوفیز اسیدوفیلیك یا كروموفوبیك ) ایجاد میشود .
در حاملگی نرمال سطوح هورمون رشد هیپوفیز بصورت اپی توپهای جفتی ترسح میشوند .تشخیص ان توسط سطح سرمی افزایش یافته IGF-1 است .
كمتر از صد مورد آكرومگالی طی بارداری گزارش شده است
حاملگی در زنان با آكرومگالی احتمالا" نادر است چون نیمی از انها هیپرپرولاكتینمیك هستند و ان اوولاتوری .
در طول حاملگی این بیماران بمیزان اندكی در ریسك افزایش یافته دیابت بارداری و هایپرتنشن هستند .
درمان مشابه انچه برای پرولاكتینوما است میباشد . با مانیتورینك تنگاتنگ برای سمپتومهای بزرگ شدن تومور.
درمان با آگونیست دوپامین كمتر از پرولاكتینوما موثر است .
رزكشن ترانس اسفنوییدال كه خط اول درمان برای غیر حامله ها در نظر گرفته میشود ممكن است برای بزرگ شدن سمپتوماتیك تومور طی بارداری لازم باشد .
در سال 2006 گزارش كردند : یك كیس با آپوپلكسی هیپوفیز (سكته ناقص هیپوفیز ) كه نیازمند رزكشن اورژانسی ترانس اسفنوییدال آدنوم و زایمان C/S در 34 هفته شد .
درمان موفق زن حامله با لیگاند رسپتور سوماتوستاتین OCTREOTIDE و با انالو گ G.H بنام PEGVISOMANT در سالهای 2013-2015 هم گزارش شده است
منبع بارداری وزایمان ویلیامز
نوشته وگردآوری راضیه فرقانی












نظرات شما